VENTANILLA - CALLAO (PERÚ)
Telefax.511. 553.0981. E-mail. lebr7@yahoo.com


VENTANILLA - CALLAO (PERÚ) |
|
|
| •
Página principal • Indice de productos |
• Venta
de productos • Páginas peruanas |
• Venta
de Maquinarias • Programas Gratis |
• Más
Monografias • ENLACES |
|
Bienvenid@s a La Página Virtual de ALNICOLSA del Perú S.A.C. Telf: 5530981 - Ultima Actualización |
Las algas son una pieza clave de nuestra vida cotidiana. Aunque
es muy probable que podamos sobrevivir sin usar las algas y sus
diversos derivados, nuestra vida cotidiana sería muy distinta
sin ellas. Aún sin pensarlo, todo el tiempo estamos en contacto
con algún derivado de las algas. Las algas y sus derivados
forman parte de nuestra vida cotidiana en alimentos, fármacos y
a hasta en pintura y en nuestra ropa. Las algas son fuente de
muchos productos útiles. Tal es el caso de los ficoloides o
hidrocoloides polisacáridos, que son unos polisacáridos
complejos obtenidos de las algas de las divisiones Phaeophyceae
(feofitas) y Rhodophyceae
(rodófitas), que forman sustancias coloidales cuando
son dispersados en agua. Los polisacáridos recuperados de algas,
más importantes son: los alginatos, el agar, la laminarina,
fucoidina, galactanos, y la carragenina. Que tienen diversos
usos. Pero entre estos polisacáridos destacan los alginatos y el
agar.
El ácido algínico en una poliurodina compleja,
compuesta de ácido manurónico y ácido gulurónico con enlaces
b-1,4.
Los alginatos son sales de ácido algínico que pueden ser
formadas con metales ligeros como Na, K, Mg o Fe (ferroso),
que forman sales solubles en agua, dando así, alta viscosidad,
por lo que pueden ser usados como emulsionantes. O bien, las
sales pueden ser formadas con metales pesados como Ca, Al, Zn,
Cu, Cr, y Fe (férrico), que dan sales insolubles en agua, que no
tienen muchos usos. Los
alginatos juegan una parte
importantísima en nuestra vida cotidiana, constantemente y
sin saberlo, los comemos y hasta nos los embarramos en la piel o
en nuestras paredes. Estos importantes polisacáridos recuperados
de feofitas, tienen numerosas aplicaciones en el campo de la
medicina, por ejemplo, son usados para hacer impresiones
dentales, y como excipientes de medicinas que deben ser
lentamente absorbidas por el cuerpo. Son usados para emulsionar
fármacos y complementos vitamínicos, también las cápsulas que
tomamos con medicinas y vitaminas, están hechas de alginatos.
Pero no sólo con fines médicos nos hemos metido alginatos a la
boca, por sus propiedades coloidales y no toxicas, los alginatos
también han sido ampliamente utilizados en la industria
alimenticia. El alginato de sodio es considerado el mejor coloide
usado como estabilizador y agente cremoso para los helados. Por
eso el helado casero nunca queda igual al helado comercial.
Aunque no comas helado, no quedas exento de comer alginatos, pues
los encontramos en sopas, cremas, salsas (como la cátsup) y
aderezos (mostaza y mayonesa), como agentes que las hacen más
espesas. Las leches saborizadas que llevan los niños de lunch a
la escuela, tienen alginatos, que en los ingredientes están
discretamente señalizados como
“estabilizadores”. Un gel de alginato, cubre el paté
que comeremos esta Navidad, e incluso es utilizado para congelar
el pescado. Y si no fuera suficiente con comernos los alginatos,
los usamos también en diversas formas, como en los lápices
labiales, barnices de uñas, cremas de rasurar, shampoos y cremas
para el cuerpo. Son los emulsionantes de la pintura con la que
pintamos nuestras paredes, y son usados para el vidriado del
barro y barnizado de cerámica. Son parte importante en el
proceso de estabilización del latex, la elaboración del papel y
de ceras pulidoras. Las algas usadas para la extracción de
alginatos son diferentes en cada región. En las costas de
California se usa el género Macrocystis,
en las costas australianas el Macrocystis
y Eklonia. En las costas de
Centro y Sudamérica se usan los géneros Lessonia,
Durvillea y Macrocystis.
Otro polisacárido que tiene de origen a las algas es el
agar. Aparte de los derivados del ácido algínico, la
producción de agar-agar es considerada la otra gran industria
basada en el uso de algas. El
agar es un polisacárido muy
complejo, que en realidad es la mezcla de dos polisacáridos,
agarosa y agaropectina. El agar seco, es insoluble en agua fría
y soluble en agua caliente. Diluido en agua (en dilución del 1
al 2%), forma un gel que a una temperatura menor a 35°C es un
sólido y en una temperatura mayor a 50°C se hace líquido.
Muchos géneros de rodófitas son fuente de agar, los más usados
son Gracilaria y Gelidium.
Pero algunas especies de otros géneros también dan un agar de
calidad. El agar tiene diversos usos comerciales, pero el más
conocido de todos ellos, es el de medio de cultivo. El agar es
utilizado en la microbiología como medio cultivo por que tiene
la propiedad de no poder ser digerido ni atacado por los
microorganismos cultivados. Sin embargo también tiene muchos
usos que tienen que ver con nuestra vida cotidiana, por ejemplo,
es el ingrediente principal en la elaboración de conservas de
carne y pescado, evitando el desagradable “sabor a
lata”. Las latas de ostiones, anchoas, mejillones, sardinas
y jamón enlatado que compramos, están conservados con agar, lo
que también le da una textura gelatinosa. En menor grado,
también hemos comido agar en conservas de cereales y comida
precocinada para calentar en el microondas. Todos seguramente
hemos comido agar en algún momento de nuestra infancia, en forma
de dulces, principalmente como panditas, gusanitos, frutitas,
corazones y todo tipo de gomitas. Es usado como estabilizador en
la elaboración de quesos (como el queso amarillo), y es el
ingrediente principal (por tener un tipo de pectina) para espesar
mermeladas y hacer jaleas. Incluso es usado como agente
clarificante de vinos, licores y de la cerveza. Por supuesto que
el agar no podía quedarse atrás y también tiene importantes
usos en la farmacología. Pues tiene la capacidad de pasar por el
estómago sin ser digerido, así que forma la cubierta de todas
nuestras pastillas que deben ser absorbidas por el intestino.
También es usado como emulsionante de la mayoría de los
laxantes en el mercado. Pero curiosamente el agar tiene más usos
fuera de esas dos industrias. Es muy usado en la industria
textil, ayudando a dar forma a la tela y así garantizar la
talla. Esa capa como de plástico que endurece a la ropa nueva,
es en realidad una agarina. Las películas fotográficas usan el
agar como aglutinante de los polvos receptores de luz. El agar es
incluso usado para la elaboración de ciertos pegamentos como el
que une a las grapas en prácticos paquetes que podemos pones en
nuestras engrapadoras. También es usado para la elaboración de
pinturas, como óleos.
Esos son sólo dos de los miles de ejemplos que hay sobre la importancia de las algas en nuestra vida cotidiana. Y aunque muchas veces ignoradas, las algas nos siguen sirviendo en muchas formas, ya sea por sus polisacáridos, o como una de las mejores fuentes de potasa para nuestros jabones y el yodo que tiene nuestra sal. Como fuente de pigmentos, como forraje o como fertilizante. Incluso como alimento, pues son considerados manjares en muchas partes del mundo. Y hasta nos sirven como resaltador de todos nuestros señalamientos viales, en forma de tierras diatomáceas. En fin, las algas, aunque casi siempre en el anonimato, han formado y seguirán formando una pieza clave en nuestra vida cotidiana.
ANTECEDENTES
TAXONOMÍA Y DISTRIBUCIÓN
En América, los primeros estudios sobre algas datan de aproximadamente 250 años
atrás, época en la cual se realizaron numerosas expediciones, principalmente por
europeos y norteamericanos para recolectar especies exóticas. Las primeras
colecciones de la flora algal peruana, pertenecen a Coker (1903-1906) y fueron
estudiadas por Howe quien en 1914 publicó "The marine algae of Peru",
reconociendo un total de 96 especies para nuestra costa. Colecciones posteriores
que incluyen a Ecuador, Perú y Chile han contribuido en el conocimiento de la
riqueza florística de la costa temperada del
Pacífico Sur. Para el Perú, es importante citar los trabajos realizados por
Dawson et al., (1964) y Acleto (1973; 1980).
Santelices (1980) en su trabajo sobre la
fitogeografía de la costa templada del Pacífico sur, concluye que esta flora
incluye 380 especies de algas rojas, pardas y verdes las cuales son de
influencia principalmente subantártica. Ramírez & Santelices (1991) en una
recopilación de toda la información bibliográfica de la costa templada del
Pacífico sur, mencionan un total de 746 especies de algas, de las cuales 469 son
Rhodophyta, 149 Phaeophyta y 128 Chlorophyta. Acleto (1988) menciona para el
Perú un aproximado de 225 especies, de las cuales 160 son rojas, 31 pardas y 37
verdes.
Las algas rojas, comprenden el grupo más grande de las algas marinas con
alrededor de 4000 especies (Lee, 1992). Dentro de este grupo, la familia
Gigartinaceae ha presentado siempre problemas en su taxonomía debido a la
extrema variabilidad morfológica de la mayoría de sus miembros (Hommersand et
al., 1993). La importancia económica de este grupo, con especies productoras de
carragenano, motivó el interés de diversos investigadores a fin de esclarecer la
identidad de sus miembros.
Hommersand et al. (1993) presentaron un nuevo sistema de clasificación de las
Gigartinaceae, teniendo en cuenta las características morfológicas y de
desarrollo de las estructuras reproductivas, y propusieron la inclusión de 7
géneros para esta familia, restableciendo el género Chondracanthus Kützing
independiente del género Gigartina Stackhouse.
Chondracanthus chamissoi (C.Agardh) Kützing fue descrita en 1843 en base a
material recolectado en Chile por Chamisso, material depositado en el Herbario
Agardh, Lund, Suecia (Dawson et al., 1964). Esta especie se caracteriza por
presentar un talo membranáceo de 6 a 45 cm de altura. Su color varía de un verde
oscuro a un marrón rojizo, o casi negro. Está constituido generalmente por
varios ejes axiales cilíndricos en la base y divididos subdicotómicamente, que
derivan de un disco basal pequeño. Las ramificaciones son dísticas o pinnadas,
abundantes, las ramas laterales son de diferente tamaño y longitud. Los
cistocarpos esféricos, se desarrollan en forma notoria y más o menos aglomerados
a lo largo del margen de las ramas (Acleto, 1986a).
El área de distribución de C. chamissoi abarca las localidades de Callao,
Barranco, Isla San Lorenzo, Talara, Chimbote, Paracas, Ancón, San Bartolo,
Pucusana, Pisco, Bahía Independencia e Islas Chincha (Dawson et al., 1964). En
1986, Acleto incluye en esta relación, al departamento de La Libertad. Ramírez &
Santelices (1991) en una revisión bastante extensa de las algas marinas de la
costa de Sudamérica, señalan como área de distribución de C. chamissoi a Perú y
Chile y en 1997, Hoffmann & Santelices, la señalan como una especie endémica de
Perú y Chile que se distribuye desde Piura (Perú) hasta Chiloé (Chile).
ECOLOGÍA
Chondracanthus chamissoi es un alga endémica de la costa templada del Pacífico
sur que habita en las zonas rocosas del intermareal y submareal. Su presencia en
sectores influidos por oleaje o corrientes fuertes está determinada por
condiciones fisiológicas como resistencia de los sistemas de fijación al
sustrato, flexibilidad y firmeza de las frondas para soportar el embate del mar.
Las frondas cistocárpicas de esta
especie presentan una mayor resistencia a la tracción debido al incremento
celular que ocurre durante el proceso de formación de cistocarpos, lo que
permite una mayor compactación de la fronda y por lo tanto una mayor resistencia
(Donoso & Alveal, 1988).
A pesar de que las fases gametofíticas y tetrasporofíticas se encuentran
presentes al mismo tiempo, C. chamissoi presenta una dominancia de la fase
tetrasporofítica y un marcado crecimiento estacional con respecto a la talla y
abundancia. Ambas fases presentan estructuras reproductivas durante todo el año,
sin guardar una relación definida entre la presencia de estas estructuras y el
tamaño de la planta (Rojas, 1976; Acleto, 1986b).
IMPORTANCIA ECONÓMICA
En el continente asiático, 2000 años a. C., ya se tenía conocimiento de las
algas, no sólo como alimento, sino también, en la medicina y como fertilizantes
(Hansen et al, 1981). En 1914, Howe sugirió la posibilidad de industrializar las
algas. En la actualidad, su uso se ha incrementado por las múltiples
aplicaciones de los polisacáridos de la pared celular (agar, carragenano y
alginato), que se obtienen de algunas especies de algas rojas y pardas (Glicksman,
1987; Kloareg & Quatrano, 1988).
En el Perú, el "yuyo" ( Chondracanthus chamissoi) y el "cochayuyo" ( Porphyra
spp) han sido utilizados como alimento desde la época preinca, tanto en la costa
como en la sierra (Acleto, 1986a).
QUÍMICA DE POLISACÁRIDOS
El agar y el carragenano son polisacáridos presentes en la pared celular de
algas rojas (Rhodophyta). Ambos están constituidos por unidades repetitivas de
galactosa y galactosa anhidra, diferenciándose solamente en la configuración que
adopta esta última, si está en posición L- corresponde al agar, si se presenta
en posición D-, corresponde al carragenano (Matsuhiro, 1986; Kloareg & Quatrano,
1988).
Mientras que el agar se presenta en una forma
relativamente simple y constante en su composición (Fig. 1), el carragenano
puede presentar diferentes tipos debido a diversos grados de sulfatación de sus
moléculas (Dring, 1996). Estas diferencias en su estructura química, se
encuentran estrechamente relacionadas a su solubilidad en cloruro de potasio,
habiéndose clasificado en dos familias, la primera constituida por una fracción
no soluble denominada k-carragenano y la otra, por una fracción soluble
denominada l-carragenano (Smith & Cook, 1953; Waaland, 1975; Falshaw & Furneaux,
1998).
Los k-carragenano son utilizados como agentes gelantes y consisten de un
esqueleto repetitivo de 3,6- anhidrogalactosa y galactos a 4-sulfato (Fig. 2a),
mientras que en los l-carragenano, utilizados como espesantes y/o emulsificantes,
la molécula anhidra es reemplazada por galactosa-2,6- disulfato (Fig. 2b) (McCandless
et al., 1983; Glicksman, 1987; Rochas et al., 1989; Dring, 1996).
Craigie (1990), encontró diferencias en la calidad
y rendimiento de gel según la edad del tejido. En este sentido, la producción de
carragenano en Chondrus crispus se encuentra altamente influenciada por la
estación (Saito & de Oliveira, 1990) o por la porción de talo (Rivera-Carro et
al., 1990). Otros estudios mencionan que factores implicados en regular el tipo
y cantidad de carragenano están asociados con cambios estacionales (irradiación,
disponibilidad de nutrientes, temperatura) y ciclo de vida (Craigie, 1990).
Estudios realizados en diferentes algas carragenofiticas encontraron
estacionalidad en la producción de carragenano. También mencionan la existencia
de una posible interacción de muchos factores que probablemente sean
responsables de los cambios estacionales del carragenano habiendo encontrado una
correlación entre el rendimiento de carragenano y nutrientes (Dawes et al.,
1974).
CALIDAD DE CARRAGENANO
Desde hace varios años, la espectroscopía infrarroja ha sido utilizada en el
estudio de polisacáridos de algas (Cerezo, 1967; Anderson et al., 1968;
McCandless et al., 1973; McCandless et al., 1975; Garay et al., 1976; Doty &
Santos, 1978; Matulewicz & Cerezo, 1980; Mollion, 1980; McCandless et al., 1983;
Rochas et al.,1989). Recientemente esta técnica ha sido perfeccionada mediante
la transformada de Fourier (FT-IR). Así, el espectro FT-IR ha permitido
reconocer los diferentes tipos de carragenano por la presencia o ausencia de
bandas características a partir del alga molida o su extracto (Chopin & Whalen,
1993). Por otro lado, Matsuhiro & Rivas (1993) demostraron una notoria mejoría
en la resolución y ancho de banda cuando aplicaron una segunda fórmula
matemática sobre el espectro, denominada segunda
derivada la cual había sido propuesta anteriormente para celulosa y derivados.
DISCUSIÓN
PROPORCIÓN DE FASES
La alternancia de fases en algas rojas está estrechamente asociada con dos
conceptos ecológicos, persistencia y abundancia, que explican mecanismos y
procesos dinámicos que tienen lugar dentro de la estructura poblacional de estas
algas. En este sentido, se afirma que la fase tetrasporofítica es persistente en
el tiempo, mientras que la gametofítica depende de la rapidez de su crecimiento
siendo dominante sobre la
esporofitica bajo ciertas condiciones ambientales (Hawkes, 1990; Bulboa &
Macchiavello, 2001). Lazo et al. (1989) mencionan que la dominancia de la fase
gametofítica es un evento raro pero común en algunas Gigartinaceae y puede
variar de acuerdo a su ubicación geográfica o por las características
ambientales a las que está sometida.
En poblaciones de Chondrus crispus en Canadá se ha observado una ligera
dominancia de la fase gametofítica en la mayoría de las áreas estudiadas por
Lazo et al. (1989). Esta dominancia ha sido notoriamente más significativa en
poblaciones de Gigartina skottsbergii de Argentina y Chile ( Piriz, 1996;
Zamorano & Westermeier, 1996). Este mismo patrón ha sido observado anteriormente
para C. chamissoi en la
Bahía de Ancón, Perú (Córdova et al., 1997), y en Puerto Aldea, Chile (González
et al., 1997). La dominancia de la fase esporofitica de C. chamissoi entre
agosto de 1978 y julio de 1979 ha sido mencionada por Acleto (1986b) y durante
el año 2000 por Magallanes et al. (2001) en áreas que actualmente se encuentran
dentro de la Reserva Nacional de Paracas.
En el presente estudio, la dominancia de la fase gametofítica encontrada desde 1997 hasta los primeros meses de 1999 respondería a la anomalía térmica positiva registrada durante 1997 y 1998, mientras que la anomalía térmica negativa observada en 1999, habría provocado, la disminución en la proporción de gametofitos hasta llegar a una dominancia de la fase esporofítica en agosto de ese mismo año. La dominancia de esporofitos a partir de 1999 se corrobora con los trabajos de Magallanes et al. (2001) y Riofrío et al. (2001) que coincidieron en mencionar la dominancia de esta fase para la Reserva Nacional de Paracas y la Bahía de Ancón durante el 2000, respectivamente.
PARÁMETROS POBLACIONALES
Los factores oceanográficos que interactúan con las algas marinas son muy
complejos y varían constantemente (Lobban & Harrison, 1994), habiéndose llegado
a establecer que la temperatura, irradiación y nutrientes son los principales
factores que determinan el desarrollo óptimo de estos organismos (Kain & Norton,
1990). A pesar de que la temperatura afecta procesos metabólicos de los
organismos vivos, tales como
respiración y fotosíntesis, se reconoce que estos tienen la capacidad de
aclimatación térmica enzimática, la cual les permite continuar con sus funciones
normales en zonas con estaciones climáticas pronunciadas (Lobban & Harrison,
1994). Sin embargo, los fuertes cambios interanuales de temperatura afectan la
abundancia de las algas (Ladah et al., 1999). Así mismo, se ha demostrado que
otros parámetros como crecimiento, morfología y reproducción también se han
visto afectados por factores abióticos (Lobban & Harrison, 1994).
Algunos trabajos acerca de la fenología de algas (Piriz, 1996; Zamorano &
Westermeier, 1996; García-Lepe et al., 1997; Santelices & Martínez, 1997; Reani
et al.,1998) muestran la relación existente entre los parámetros evaluados y los
factores ambientales. El incremento de la temperatura superficial del mar, desde
marzo de 1997 hasta junio de 1998, hasta 5 °C por encima de la normal ( Jaimes,
1999), sería la causa de las respuestas biológicas observadas en el presente
estudio.
La presencia de plantas más grandes en los meses de mayor temperatura coincide
con los resultados expuestos por González et al. (1997), quienes encontraron
para esta misma especie, una frecuencia significativamente mayor de frondas más
grandes durante los meses de primavera-verano. Similares observaciones fueron
advertidas para Gigartina skottsbergii de Argentina (Piriz, 1996) y de Chile
(Zamorano & Westermeier, 1996). Sin embargo, estos resultados difieren de los
hallados por Rojas (1976), para C. chamissoi, quien incluso encontró resultados
diversos entre las áreas de muestreo.
En este estudio, coincidiendo con las anomalías térmicas positivas (1997-1998),
ambas fases mostraron sus más altos valores en número de esporangios. En 1999,
su disminución coincidió con las anomalías térmicas negativas, sin embargo se
observó patrones diferentes para cada fase de su ciclo de vida. Esto último
concuerda con lo mencionado por Santelices & Martínez (1997) quienes registraron
que el potencial reproductivo de cada fase del ciclo de vida de Mazzaella
laminarioides presentaba un comportamiento estacional diferente. Los resultados
del estado de madurez reproductiva registrado para C. chamissoi nos llevan a
confirmar lo propuesto por Lobban & Harrison (1994), quienes sostienen que cada
fase del ciclo de vida de un alga presenta temperaturas óptimas características.
Tarazona et al. (2001), mencionan que los cambios oceanográficos sostenidos
originan alteraciones en las interacciones biológicas provocando la
proliferación de algunas especies y la disminución de otras. La disminución y
pronta desaparición de C. chamissoi del área de estudio desde febrero hasta mayo
de 1998, coincide con la aparición de los gasterópodos Aplysia nigra y A. inca
(Córdova et al., 1998). Estos herbívoros posiblemente tuvieron un rol activo
como factor controlador de las poblaciones de C. chamissoi.
CALIDAD Y CANTIDAD DE CARRAGENANO
Los resultados del presente estudio demostraron que el rendimiento de
carragenano de C. chamissoi varió en el tiempo sin presentar un claro patrón
estacional.
Esta ausencia de variación ha sido mencionada para otras especies de
Gigartinaceae (Piriz & Cerezo, 1991). Sin embargo, resultados opuestos han sido
encontrados para algunas especies como Chondrus crispus, Gigartina stellata (Craigie,
1990) y Gymnogongrus crenulatus, Phyllophora pseudoceranoides y P. truncata (Cosson
et al., 1990). Al mismo tiempo, en ambas fases, el contenido total del
ficocoloide presentó sus más altos valores en 1999 coincidiendo con las
anomalías negativas del nivel del mar y por lo tanto las plantas se encontraron
más expuestas a la irradiación. Craigie (1990) menciona que los cambios
estacionales en el rendimiento y calidad de ficocoloides, son difíciles de
interpretar debido a los múltiples factores involucrados.
Las diferencias en el rendimiento, con máximos valores hallados en las plantas
cistocárpicas, han sido mencionados para C. chamissoi (Ching et al., 1977) y
para Iridaea membranaceae, I. ciliata y Chondrus canaliculatus (Matsuhiro,
1986), mientras que ausencia de variación entre las fases ha sido encontrada
para I. cordata y Gigartina exasperata (Waaland, 1975).
Rivera-Carro (1990) y Zertuche-Gonzalez et al. (1993) afirman que los factores
asociados con cambios estacionales (temperatura, nutrientes y luz) son aquellos
implicados en regular el tipo y cantidad de carragenano producido. Por otro
lado, Cosson et al. (1990), sostienen que las variaciones en el rendimiento de
carragenano no están en función a las estaciones sino al ciclo vegetativo de las
especies. Craigie (1990) y Reani et al. (1998) coinciden en que existe una
correlación positiva entre el periodo de crecimiento activo y el rendimiento de
carragenano.
Trabajos con agarofitas muestran una marcada variación estacional en el
rendimiento y calidad de agar, atribuyéndolo a factores desconocidos
relacionados al medio ambiente (Rebello et al., 1996). Otros estudios revelan
que la disponibilidad de nutrientes, temperatura de crecimiento del alga, tasa
de crecimiento, edad de los tejidos, estado reproductivo y factores genéticos
están implicados como reguladores del metabolismo de ficocoloides (Craigie,
1990). Los miembros de Gigartinaceae muestran marcadas diferencias en la química
de carragenano relacionado a la fase del ciclo de vida (Craigie, 1990; Estevez
et al., 2001). En el presente estudio, los resultados demuestran que el tipo de
carragenano es constante para cada una de las fases. En 1983, McCandless et al.,
realizaron el estudio químico del polisacárido de diferentes especies de la
familia Gigartinaceae encontrando una gran uniformidad en el carragenano de
plantas del género Gigartina aun proviniendo de diferentes regiones
biogeograficas.
Las bandas de absorción, al espectro infrarrojo, de los extractos obtenidos de
plantas sin estructuras reproductivas visibles son muy similares a los
polisacáridos de las plantas cistocárpicas. Ambos muestran las características
bandas de absorción de un carragenano híbrido tipo k - i. Este término,
utilizado frecuentemente en el campo de los carragenanos, describe productos
cuyas estructuras están construidas por una mezcla de unidades idealizadas
repetitivas (Murano et al., 1997; Estevez et al., 2001; Falshaw et al., 2001).
Este hecho ha sido mencionado para diferentes especies de Gigartinales cuyas
fases gametofiticas presentan varios grados de hibridismo k - i (Correa- Díaz et
al., 1990; Saito & Oliveira, 1990; Cáceres et al., 1997).
La fase tetrasporofítica presenta un espectro acorde con un carragenano tipo l,
y algo de 3,6-anhidrogalactosa que se evidencia en la banda de absorción a 930
cm-1 . Esta señal no está normalmente asociada con carragenanos de este tipo,
sin embargo ha sido observada en diferentes especies de Gigartina de México y
Nueva Zelanda ( Correa - Díaz et al., 1990; Falshaw & Furneaux, 1998).
USOS
EN RESTAURACIÓN MEDIOAMBIENTAL Y
ACUICULTURA
El término de ALGA comprende un grupo muy heterogéneo de organismos vegetales marinos (50.000 aproximadamente) que se caracterizan por realizar la fotosíntesis , es decir el proceso que convierte la energía lumínica en energía química necesaria para la síntesis de moléculas orgánicas.
Aunque la mayoría de las algas son unicelulares y microscópicas, algunas de 1 o 2 micrómetros de diámetro (1 micrómetro = 0,001 milímetros), muchas son visibles como el verdín de las charcas, las algas marinas, la marea roja, las manchas verdeazuladas de las paredes de los acuarios, las capas verdes sobre los árboles y la nieve roja. Muchos géneros de algas tienen representantes que viven en simbiosis con hongos y forman los líquenes. Ciertas algas han evolucionado hacia la pérdida de su capacidad fotosintética. Las algas se diferencian de los briofitos (musgos y hepáticas), que también carecen de tejidos complejos, en que sus células reproductoras se originan en estructuras unicelulares y no pluricelulares. El estudio de las algas se llama ficología (del griego, phykos, que significa ‘alga de mar’) o algalogía (del latín, alga).
Las formas de algas macroscópicas suelen fijarse a una superficie firme y crecen en abundancia como algas marinas en las zonas intermareal y submareal, a una profundidad de hasta 268 m, según la penetración de la luz solar. También crecen sobre rocas que se encuentran en agua dulce estancada o corriente y, por lo general, se desprenden y flotan formando el verdín de las charcas. Las formas de algas microscópicas son en su mayoría unicelulares y planctónicas (móviles, o que flotan libremente) y constituyen una parte esencial de la cadena alimentaria de todos los seres acuáticos.
Los
científicos han clasificado las algas de diversos modos. Tradicionalmente los
botánicos han estudiado las formas inmóviles, mientras que las móviles,
incluso las fotosintéticas, han interesado también a los zoólogos. Sin
embargo, una división simplista de las algas en animales y vegetales es
incorrecta. Muchos biólogos usan, y esta enciclopedia también, un sistema de
clasificación que las distribuye en reinos diferentes. Las investigaciones
actuales sugieren que existen, al menos, 16 líneas filogenéticas (grupos de
organismos con un antepasado común). A una línea filogenética se le suele
dar la categoría de un filo en zoología y de una división en botánica.
Las líneas filogenéticas de las algas se definen
según determinadas características. Entre ellas están: los pigmentos
fotosintéticos, los productos de reserva, la composición de la pared
celular, los flagelos de las células móviles y la estructura del núcleo, el
cloroplasto, el pirenoide (zona del cloroplasto que participa en la formación
de almidón) y la mancha ocular (orgánulo constituido por una gran
concentración de lípidos). Las algas procarióticas, que carecen de membrana
nuclear, se clasifican en el reino Móneras. Las formas unicelulares de
las algas eucarióticas, que tienen su núcleo rodeado por una membrana, se
incluyen en el reino Protistas, al igual que las líneas filogenéticas
con formas pluricelulares, aunque según ciertas clasificaciones estas
últimas se incluyen en el reino Vegetal. Una hipótesis apunta que los
orgánulos de las células de las algas han evolucionado a partir de
endosimbiontes (organismos que viven en simbiosis en el interior de las
células o de los tejidos de un huésped). Los partidarios de esta teoría
sitúan a las algas eucarióticas con los protozoos, en el reino Protistas.
Los
ficólogos definen a las algas como organismos fotosintéticos con Clorofila a
y con estructura de talo
no diferenciada en raices , tallo u hojas como las plantas vasculares.
Se clasifican en 11 grupos con categoría de división .
De
entre ellos destacamos cuatro:
1. Cianofíceas (algas verde-azuladas): Son organismos procariotas fotosintéticos que poseen clorofila a , están más próximos a las otras bacterias fotosintéticas que a algas eucariotas por lo que también se les denomina cianobacterias.
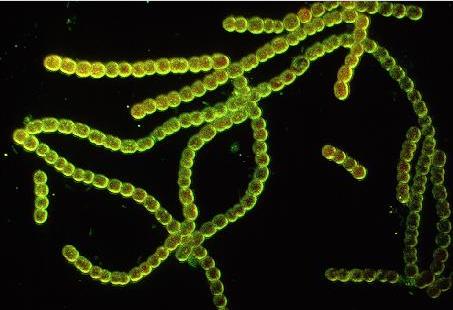 |
No obstante de acuerdo a la definición de alga indicada anteriormente están dentro del grupo de las algas . El nombre común viene del tono azulado que tienen debido a un pigmento biliproteico (ficocianina) que enmascara el color verde de la clorofila. Son organismos muy primitivos (aparecen en el Periodo precámbrico , hace 3000 años) y cosmopolitas. Entre las que tienen uso biotecnológico destaca Spirulina que se emplea como alimento por su alto contenido en proteínas (hasta el 70% del peso seco). Muchos de estos organismos tienen capacidad de fijar nitrógeno atmosférico al tener el sistema enzimático nitrogenasa. |
2. Rodofíceas ( Algas rojas ). El color pardo-rojizo viene dado por la existencia de biliproteínas (ficoeritrina y ficocianina principalmente ) que contribuyen a enmascarar el color verde la clorofila.
Las algas rojas son organismos eucariotas, es decir que tienen membrana nuclear y, por regla general, están confinadas a hábitats marítimos. Algunas son de gran belleza y, como los cianofitos, carecen de clorofila B y tienen pigmentos especiales rojos y azules. La mayoría se caracteriza por la presencia de puntos de conexión entre sus células que resultan de una división celular incompleta.
|
Las células sexuales carecen de flagelos (apéndices a modo de látigo usados para la locomoción). En general, su ciclo sexual es muy complicado e implica una alternancia de generaciones, de morfología similar o diferente, y una fase posterior de fecundación que se desarrolla sobre el órgano femenino. Las paredes celulares de las algas coralinas están impregnadas con una forma de carbonato de calcio llamado calcita. Estas algas son importantes en la formación de los arrecifes de coral, al producir material nuevo y sedimentarse junto a otros organismos. Constituyen el grupo más diverso entre las algas con alrededor de 4000 especies. Aunque se encuentran en todos los mares del mundo su abundancia disminuye del ecuador a las aguas polares en comparación con algas verdes y pardas. Algunas especies pueden vivir a gran profundidad (200 m) como ciertas algas calcáreas. |
 |
Las primeras algas rojas datan de la era Paleozoica, periodo siluriano (hace 435-460 millones de años). En las paredes celulares presentan polisacáridos complejos cuya función principal es servir como cemento (coloide) que cohesiona la estructura del alga. Los ficocoloides (agar y carragenatos) son los principales productos de interés industrial en estas algas.
Las paredes celulares de ciertas algas rojas son la única fuente de donde se extraen dos carbohidratos polisacáridos de gran importancia económica: el agar y el carraguín. Ambas sustancias están químicamente relacionadas y tienen propiedades suspensivas, emulsionantes, estabilizantes y gelidificantes. El agar es conocido por su uso en la preparación de los medios de cultivo para los microorganismos; el carraguín por su empleo en la fabricación de productos lácteos, aunque también se usa en la industria textil, en cosmética, en farmacia y en tipografía. Varias algas rojas, de las cuales la más conocida es el nori, son importantes en la dieta de algunos pueblos, especialmente en Japón.
3. Feofíceas (algas pardas): Las algas pardas, como las algas rojas, se encuentran principalmente en hábitats marinos. La coloración parda, de tonalidad muy variable, es debida a la presencia de ciertos pigmentos carotenoides (fucoxantinas). También carecen de clorofila B; además de la clorofila A poseen clorofila C.
Las algas pardas se conocen por su crecimiento rápido, su inmenso tamaño y por sus tejidos relativamente complejos.
 |
Son algas eucariotas , pluricelulares y morfológicamente muy diversificadas, encontrándose sólo en agua de mar y con forma que van desde algas filamentosas de estructura sencilla hasta algas que ya tienen tejidos diversificados por los que se realiza transporte de nutrientes dentro de la planta. Las algas pardas dominan en las aguas frías, particularmente en el hemisferio norte. Se fijan al sustrato mediante rizoides formando auténticos bosques o praderas como las de Laminaria en el Atlántico o Macrocystis en el Pacífico. En los trópicos la única zona con gran abundancia de algas pardas es el Mar de los Sargazos. Constituyen las algas más modernas ya que los primeros registros fósiles datan del periodo terciario, en el mioceno (hace 25 millones de años). |
En la pared de algunas especies se encuentran coloides denominados alginatos, además muchas algas pardas poseen también interés agropecuario, en la alimentación humana, farmacología y cosmética.
El alginato, un polisacárido que se obtiene de los feofitos, se usa y comercializa del mismo modo que el agar o el carraguín. Las algas pardas son también fuente de vitaminas y minerales y se utilizan como fertilizantes. Algunas especies (como el kobu) constituyen un aporte alimenticio importante, especialmente en la comida japonesa.
4. Clorofíceas (algas verdes). Las algas verdes se asemejan a las plantas superiores en que tienen clorofila A y B y almidón como material de reserva. La mayoría son unicelulares o coloniales y constituyen una parte importante del plancton de los hábitats de agua dulce. Muchos clorofitos unicelulares se agrupan en filamentos y son visibles como musgo de río o verdín de charca. Las algas verdes de agua dulce más evolucionadas son las carofíceas. En hábitats marinos las más desarrolladas se componen de sifones plurinucleados y alcanzan una longitud de 10 metros. Un género tiene las paredes celulares impregnadas con una forma de carbonato de calcio llamada aragonita y contribuye de modo importante a la formación de los arrecifes de coral. Algunos estudios indican que, probablemente, las carofíceas y otros clorofitos evolucionaron hacia los briofitos y las plantas superiores.
|
Son algas que han colonizado todos los ambientes, encontrándose el 90% de las especies en agua dulce y el 10% restante en aguas marinas . Las especies de agua dulce tienen una distribución cosmopolita. En ambientes marinos tropicales y semitropicales el número de especies es bajo y el mismo en todas las zonas del mundo a esa latitud, en cambio en aguas frías y templadas la diversidad es más alta. Las clorofíceas aparecen en la era paleozoica , periodo Ordoviciano (hace 500-530 millones de años) y constituyeron los antecesores de los vegetales terrestres. Hay una gran diversidad morfológica, desde algas unicelulares a pluricelulares bastante complejos. |
 |
Las algas verdes se localizan también en el suelo húmedo, adheridas a las plantas terrestres (algunas son parásitas), e incluso en la nieve y el hielo. Las formas marinas son fáciles de ver en las rocas costeras cuando baja la marea. También hay algas terrestres que se combinan en asociaciones simbióticas con hongos, llamadas líquenes.
Las algas verdes se reproducen de forma vegetativa por fragmentación y división celular; asexual por esporas y zoosporas, que se desarrollan directamente para convertirse en nuevos individuos; y sexual por conjugación (unión de dos células sexuales llamadas gametos). En muchas especies se da la alternancia de generaciones, en cuyo caso la generación de gametofitos es dominante, al contrario que en las plantas con semilla, donde la fase de esporofitos es la predominante. Las algas verdes tienen una enorme importancia en la cadena alimentaria, es decir, constituyen una fuente de alimento para otros organismos acuáticos (véase Plancton), además contribuyen al aporte de oxígeno atmosférico. Sin embargo, pueden tener efectos negativos cuando la población aumenta demasiado porque provocan mal olor y sabor desagradable en el agua potable y obstruyen los filtros de las depuradoras. En lagos y charcas de agua dulce contaminada por nitratos y fosfatos, la población de algas crece rápidamente hasta llegar al máximo. Por este motivo aparece en el agua una espuma densa y maloliente y se produce un drástico descenso del oxígeno disponible, necesario para otras formas de vida acuática.Los ficocoloides tienen menos interés que el de algas rojas y pardas pero estas algas tienen otros usos: agropecuario, alimentación humana, sistemas de regeneración ambiental (depuración de efluentes) y en la industria farmacéutica.
Desde tiempos pasados , el hombre ha usado las algas con distintos fines . En China desde el año 2700 A.C. y los griegos y romanos las usaban como alimentación, para el forraje como plantas medicinales y en cosmética. Los aztecas empleaban la cianobacteria Spirulina, que recolectaban el lago Texcoco, como complemento proteico. Actualmente tienen usos industriales, agropecuarios, alimentación, médico-farmacológicos y en restauración medioambiental. La cantidad de algas transformadas en todo el mundo es del orden de 7 billones de toneladas de peso fresco , siendo los países asiáticos los productores de casi el 80 % de las materias primas.
|
En España , los agricultores del Norte y noroeste han empleado algas como abono de las tierras de cultivo, en algunos lugares se han consumido y finalmente se cuenta con industrias de extracción de agar muy importantes a nivel mundial. |
|
USOS
INDUSTRIALES: FICOCOLOIDES
De
las paredes de lagas rojas se extra los polisacáridos agar y
carrgenatos , mientras que de la de algas pardas se extraen los alginatos.
|
|
El
agar se emplea en la elaboración de medio de cultivo en laboratorio
por tener un gran poder gelificante
a temperaturas de 34-38 oC (agar
extraido de Gelidium)
y 40-52 oC (agar extraido de Gracilaria)
lo que permite añadir los organismos que se quieren cultivar de un
modo homogéneo. El agar
se puede esterilizar a temperaturas > 100 oC sin que
pierda el poder gelificante. |
El agar se añade como aditivo gelificante y espesante (Código E-406) en gran cantidad de alimentos (confituras, merengues , helados etc. ) . También se emplea por la industria fotográfica (estabiliza la nitroglicerina) , industria biotecnológica (agarosa para separaciones cromatográficas y electroforéticas). Las especies más empleadas en la extracción de agar pertenecen al género Gelidium, Pterocladiella , Gelidiella y Gracilaria.
Los carragenatos , son poligalactanos , polímeros lineales de moléculas alternadas de D-galactosa y 3-6 anhidro-D- Galactosa unidas por enlace a 1-3 y b 1-4 . El carácter hidrofílico y la solubilidad lo dan los grupos sulfatados en las moléculas de galactosa . las propiedades espesantes y gelificantes las hacen muy útiles en la industria alimentaria, el 80% del carreganato extraído en el mundo se emplea como espesante y agente estabilizante (E-407) en productos lácteos, postres de tipo gelatina, jugos de fruta, mermeladas, helados etc. Otro usos son en cosmética (pasta de dientes, barras aerosoles) e industria farmacológica (contra úlceras gástricas e infecciones víricas). Se usan unas 15 especies en al extracción de carragenatos destacando Chondrus crispus, Mastocarpus stellatus, Euchema sp , esta última se cultiva en Filipinas e Indonesia y contribuyen alrededor de un 80% de la producción mundial.
Los alginatos , son polisacáridos constituidos por unidades de b-D-manurónico y a-L- Gulurónico. Disueltos en una pequeña cantidad de agua tienen un gran poder espesante , gelificante y estabilizante. El 50 % del alginato extraído se emplea en la industria textil , un 30% en la industria alimentaria con los códigos : E-401, E-402, E-403, E-404, E-405 y E-405) ya que aportan textura y consistencia evitando la formación de cristales de hielo, el resto se usa en la industria celulosa (suavizar la superficie del papel), industria farmacéutica (excipientes y preparación de apósitos) e industria cosmética (jabón , champús , barras de labios, espumas de afeitar) . De las 300 especies potencialmente útiles se utilizan unas 12 , destacando Macrocystis pyrifera, Laminaria hyperborea, Laminaria digitata, Saccorhiza polyschides, Ascophyllum nodosum y Fucus sp..
Los
arribazones de algas han constituido una fuente de abono
para las tierras de cultivo. Aparte de abonar las algas mejoran las
características nutritivas del suelo e impiden el crecimiento de malas
hierbas. Se emplean también como complemento en la dieta del ganado .
Actualmente hay empresas que fabrican harinas de algas para ser suministradas
al ganado.
|
|
Por
último se han desarrollado fertilizantes basados en extractos líquidos
de algas ya que se ha probado que aumentan la resistencia de los
cultivos a las heladas y
plagas y además
estimulan el crecimiento y producción vegetal.
|
|
|
El consumo directo de algas en la alimentación humana está mucho más extendido en los países orientales (China, Corea, Japón) que en los occidentales. |
|
Así por ejemplo el uso de Porphyra como alimentado data al menos del 535 a.c.. Porphyra es conocida como Nori (Japón) , Zikai (China) , Kim (Corea) o Karengo (Nueva Zelanda), y se cultiva en la bahía de Tokio desde alrededor 1640 y desde hace 200 años en China. |
|
|
|
Esta especie constituye con gran diferencia la especie de Rhodophyta que más se consume en el mundo para alimento, tras diferentes algas pardas. En 1990 el consumo de algas fue de unas 400.000 Toneladas de peso seco (Tabla 1) |
Tabla 1 . Producción de algas como alimento (1991)
|
Especie |
Nombre popular en Oriente |
Clase |
Producción (Toneladas de Peso Seco) |
|
Laminaria spp |
Kombu |
Phaeophyta |
294.600 (64.8%) |
Undaria
pinnatifida
|
Wakame |
Phaeophyta |
81.400 (17.9%) |
|
Porphyra
spp. |
Nori |
Rhodophyta |
69.130 (15.2%) |
Hizikia fusiformis |
Hijiki |
Phaeophyta |
9.600 (2.1%) |
Son apreciadas por sus
propiedades nutritivas y características organolopédicas. Algunas algas
poseen características
nutritivas de gran interés en comparación con vegetales terrestres (Tabla 2)
Tabla 2. Contenido nutricional en diversos vegetales terrestres (expresado como g de producto comestible por 100 g) y en diversas algas (expresado como g por 100 g de peso seco)
|
Vegetal |
Agua (g) |
Proteína (g) |
Grasas (g) |
Carbohidratos (g) |
Ca (mg) |
Fe (mg) |
Caroteno (mg) |
|
Pepino |
96 |
0.8 |
0.1 |
2.4 |
15 |
0.4 |
0.22 |
|
Zanahoria |
88 |
0.9 |
0.2 |
9.2 |
40 |
0.7 |
11.0 |
|
udías |
74 |
7.0 |
0.3 |
16.8 |
20 |
1.7 |
0.55 |
|
Maíz |
73 |
3.5 |
1.0 |
21.4 |
3 |
0.7 |
- |
|
Lechuga |
94 |
1.3 |
0.2 |
2.8 |
25 |
1.3 |
1.6 |
|
Porphyra |
86 |
42 |
1.8 |
42 |
470 |
23 |
- |
|
Palmaria |
83 |
18 |
2.5 |
- |
560 |
50 |
- |
|
Ulva
|
78 |
18 |
0.6 |
44 |
730 |
87 |
- |
|
Laminaria
|
88 |
12 |
1.5 |
- |
800 |
15 |
- |
|
Spirulina |
- |
66 |
- |
- |
1400 |
15 |
- |
|
Vegetal |
Vit. A (IU) |
Thiamine (mg) |
Riboflavine (IU) |
Niacina (mg) |
Vit.C (mg) |
|
Pepino |
145 |
0.02 |
0.012 |
0.2 |
8.0 |
|
Zanahoria |
4400 |
0.05 |
0.04 |
1.0 |
5 |
|
Judías |
370 |
0.31 |
0.13 |
2.2 |
25 |
|
Maíz |
- |
0.15 |
0.12 |
1.7 |
12 |
|
Lechuga |
1070 |
0.08 |
0.1 |
0.5 |
15 |
|
Porphyra |
38400 |
0.21 |
1.0 |
3.0 |
20 |
|
Palmaria |
26600 |
0.4 |
0.5 |
4 |
200 |
|
Ulva
|
960 |
0.06 |
0.03 |
8.0 |
10 |
|
Laminaria
|
430 |
0.08 |
0.32 |
1.8 |
11 |
|
Spirulina |
23 000 |
3.7 |
- |
- |
20 |
Tabla
3 . Uso de distintas algas y sus características específicas culinarias
|
Nombre
popular |
Especie |
Procedencia |
Principales
aportes |
Características
específicas |
|
Nori |
Porphyra
yezoensis (alga
roja) |
Japón,
China |
Proteínas Vitamina
A |
Combina
con alimentos fritos |
|
Kombu |
Laminaria
japonica (alga
parda) |
China
|
Yodo,
Vitamina B12 |
Da
sabor , ablanda y endulza |
|
Wakame |
Undaria
pinnatifida (alga
parda ) |
Japón |
Calcio,
Vitam. B y C |
Combina
con vegetales terrestres |
|
Dulse |
Palmaria
palmata Dilsea
carnosa (algas
rojas) |
Atlántico
Norte |
Minerales
y Proteínas |
Combina
con cereales cocinados |
|
Iziki |
Hizikia
fusiformis (alga
parda) |
Extremo
Oriente |
Minerales
y Oligoelementos |
Combina
con tubérculos |
|
Alaria |
Alaria
esculenta (alga
parda) |
Aguas
Atlánticas |
Minerales
y Vitaminas |
Ingredientes
para sopas |
|
Cochayuyo (frondes) Huilte (base
de los estipes) |
Durvillaea
antarctica (alga
parda) |
Chile
|
Yodo
y Vitaminas |
Huilte:
consumida fresca en ensaladas Cochayuyo: secadas al sol se utilizan en
diversos platos (empanadas) |
|
Espirulina |
Spirulina
(cianobacteria) |
zonas
tropicales y subtropicales |
Proteínas
y aminoácidos |
Suministrada
como complemento dietético (comprimido) |
La aplicación en la medicina tradicional es muy común en el sudeste asiático . En la industria farmacológica su uso está relacionado con su poder gelificante , sin embargo también se han encontrado actividad antitumoral, antioxidante , anti-úlceras etc.
|
Se ha demostrado que dieta rica en Porphyra. tenera reduce la incidencia de tumores intestinales y cáncer de mama en animales de laboratorio. Esta propiedad parece estar relacionada con el contenido de ésteres de S en las polisacáridos de pared y con el contenido en Vitamina A y b-caroteno (un talo contiene 27% de la cantidad diaria recomendada ). Por otro lado reduce el nivel de colesterol siendo la sustancia activa b-homobetaina . |
|
La utilización terapéutica de las algas está extendida en homeopatía : Así el musgo de irlanda (Chondrus crispus) produce una gran cantidad de mucílago que le confiere propiedades emolientes, laxantes y expectoantes y contra el estreñimiento crónico, extractos de laminaria (Laminaria sp.) dilata los conductos del organismo (p.e. cuello del útero) y el sargaso vejigoso (Sargassum sp. , Fucus vesiculosus) combate paperas, infartos glandulares , la gota y la obesidad . Se está investigando la eficacia de las algas contra ciertas afecciones y enfermedades: trombosis , colesterol, trastornos gástricos y vesiculares, astenias, reumatismo y espamofilia.
Las
aplicaciones cosméticas son las más conocidas , se emplean en cremas,
mascarillas, champúes , lociones etc. La acción benéfica de las algas se
manifiesta sobre todo en el tratamiento de uñas rotas, acné, caída del
cabello, antiarrugas, seborrea, y barros.
|
|
También
constituyen un excelente complemento en las curas de
rejuvenecimiento de la piel o
incluso contra la obesidad y la celulitis . Actualmente está
creciendo su uso en dietética y talasoterapia. |
USOS
EN RESTAURACIÓN MEDIOAMBIENTAL Y
ACUICULTURA
|
Actualmente
se investiga el uso de las algas en la depuración de efluentes de
piscifactorías cargados
de compuestos de nitrógeno (amonio y urea)
y carbono que al ser consumidos por las algas
reducen la eutrofización de aguas costeras. Por otro lado
también se están desarrollando sistemas de poli-acuicultura
integrada en el que las algas crecidas en
efluentes de
granjas de cultivo de peces o moluscos sirven de complemento dietético
para los propios animales. |
|
CARACTERIZACION BIOQUIMICA
DEL ALGA GIGARTINA CHAMISSOI
El presente trabajo de investigación pretende contribuir al conocimiento de la composición bioquímica del alga roja Gigartina chamissoi haciendo uso y adaptando metodologías básicas y no muy complicadas, empleadas en Bioquímica para el análisis de vegetales, permitiendo conocer su composición química proximal, el contenido de ciertos minerales y vitaminas, teniendo como finalidad la revaloración de este recurso como fuente de principios inmediatos o de elementos biogenésicos.
De esta manera se podrá evaluar esta alga como una nueva fuente alimenticia y su valoración como insumo en las diferentes ramas industriales. Se espera también que los resultados de este trabajo puedan ser empleados para posteriores estudios en Quimiotaxonomía de algas.
MATERIALES Y MÉTODOS
1. Material
1.1 Material biológico
Las algas analizadas fueron recolectadas en la
Bahía de Ancón en la zona conocida como playa de San Francisco
(11° 45.9 S 77° 11.7 W) durante el periodo correspondiente a
los meses de Octubre y Febrero. En la recolección se empleó la
técnica conocida como "arrancado", en las cuales los
ejemplares son extraídos muy cerca del órgano de fijación. Las
algas recolectadas fueron lavadas en el agua de mar,
transportadas después al laboratorio, lavadas nuevamente varias
veces con agua potable a fin de eliminar el contenido de arena,
pequeños animales marinos, conchillas, y toda materia extraña
perceptible macroscópicamente.
Las algas ya limpias, fueron cortadas en pequeños trozos, sometiéndolas a secado ambiental por unas 4 horas y desecación en estufa a temperatura de 30°C por 24 horas. Una vez secas fueron pulverizadas hasta la obtención de pequeños gránulos.
Para su empleo en las determinaciones bioquímicas el material biológico (pulverizado) fue sometido a continuos lavados con agua destilada a 37°C, a fin de desminuir el alto contenido de polisacárido, el cual podría interferir en la determinación: luego las algas son sometidas a secado a estufa a una temperatura de 20°C por 24 horas.
MÉTODOS
- Determinación del contenido de Humedad: Secado a 100 - 105°C a estufa.
- Determinación del contenido de grasa
- Determinación de Cenizas Totales. Basado en la destrucción de la materia orgánica a altas temperaturas.
- Determinación de Cenizas solubles e insolubles. Basado en que ciertos componentes de las cenizas solubles en el agua destilada y otras insolubles, pudiendo ser separadas por filtración.
- Determinación de Cenizas ácido insolubles.
- Determinación cuantitativa de Proteínas por el contenido de nitrógeno proteico total: Método Kjeldhal. Basado en la destrucción de la sustancia orgánica por acción del ácido sulfúrico concentrado hasta formar una sal de amonio. Disociación de la sal formada y absorción del amoniaco con ácido bórico.
- Determinación de proteínas solubles e insolubles: Método de Emmet modificado. Basado en la formación de un complejo de proteínas con el ión cúprico y valoración del nitrógeno soluble por diferencia con el nitrógeno insoluble.
- Determinación de Proteínas digeribles y no digeribles. Basado en la acción enzimática de la pepsina.
- Determinación de Nitrógeno amínico. Basados en el bloqueo de los grupos amino de las proteínas por la acción de la formalina.
- Determinación de Proteína verdadera y Nitrógeno no proteico: Método Stuzer. Basado en la precipitación de las proteínas por acción del hidróxido de cobre.
- Determinación del contenido de Carbohidratos o azucares reductores. Se basa en la coloración que se forma por la acción del fenol-ácido sulfúrico sobre los grupos reductores libres o potencialmente libres de los carbohidratos disueltos.
- Determinación cuantitativa de Fósforo. Se basa en la precipitación del fósforo bajo la forma de fosfomolibdato y la subsiguiente titulación con álcali.
- Determinación del contenido de Calcio por Complexometría. El método se basa en el empleo del Complexón (EDTA), que forma con los iones de calcio compuestos intracomplejos.
- Determinación de Magnesio. Ver fundamento anterior.
- Determinación de Aminoácidos libres. Por acción del etanol caliente.
- Determinación de iones por método Espectrofotometría de Absorción Atómica.
- Determinación de Vitaminas.
RESULTADOS
De la investigación realizada en Gigartina chamissoi se ha logrado los siguientes resultados:
1. COMPOSICIÓN QUÍMICA (Base seca)
| HUMEDAD (*) material fresco | 81,3200% |
| EXTRACTO ETÉREO | 00,1227% |
| CENIZAS TOTALES | 15,6100% |
| CENIZAS INSOLUBLES | 50,7750% |
| CENIZAS ÁCIDOS INSOLUBLES | 42,4090% |
| PROTEÍNAS TOTALES O PROTEÍNA BRUTA | 42,9200% |
| PROTEÍNA SOLUBLES | 04,3800% |
| PROTEÍNAS INSOLUBLES | 38,5300% |
| PROTEÍNA NO DIGERIBLE | 16,3050% |
| PROTEÍNA DIGERIBLE | 26,4310% |
| NITRÓGENO AMINICO | 280 mg % |
| PROTEÍNA VERDADERA | 42,1870% |
| NITRÓGENO NO PROTEICO | 00,7290% |
| CARBOHIDRATOS | 41,3400% |
| AMINOÁCIDOS LIBRES | N. D. |
N.D.:No detectable por el método.
2. CONTENIDO DE ELEMENTOS MINERALES EN EL ALGA (Gigartina chamissoi)
| FOSFORO | 0.3518% |
| CALCIO | 9.4148% |
| MAGNESIO | 12.6860% |
| CLORURO DE SODIO | 3.4646% |
| NIQUEL | 0.09 ppm |
| MOLIBDENO | 0.30 mg/L |
| FIERRO | 0.16 ppm |
| SILICIO | 1.10 ppm |
3. CONTENIDO DE VITAMINAS EN EL ALGA (Gigartina chamissoi)
| ACIDO ASCORBICO | 128.9 mg % |
| PIRIDOXINA | 2.32 mg % |
| TIAMINA | 0.1 mg % |
| RIBOFLAVINA | 1.7 mg % |
| CAROTENOS | 0.005 mg/kg |
CONCLUSIONES
Por las características bioquímicas encontradas para Gigartina chamissoi, bajo su forma seca y pulverizada puede llegarse a concluir:
Que constituye una fuente potencial y considerable de proteínas (42.92%), vitaminas y minerales, que permiten catalogar a esta especie como un alimento de valor nutricional importante.
Por su contenido de vitaminas (Tiamina, Riboflavina, Piridoxina y Vitamina C), se considera a esta alga como un buen componente de ser empleado dentro de dietas balanceadas para consumo, no sólo del hombre, sino de animales económicamente importantes.
Por su composición en minerales que hasta la fecha se le registra, se puede evaluar a esta alga no sólo como un recurso capaz de suministrar sales de importancia comercial para el desarrollo industrial, sino también de elementos importantes dentro de los marcos nutricionales; principalmente Fierro, Calcio, Magnesio, Fósforo y Molibdeno.
REFERENCIAS BIBLIOGRAFICAS
1. - Patricia Tabacchi B., Fred García A. Revista de Química. Vol. N°1. 21-26 pág. junio de 1994
2. - Kjeldahl, J. 1883. Anal Chem. 22-336.
3. - Sumarriva, L. 1985. Estudio de la composición Química de algunas Algas de Mayor Consumo en el Perú.
4. - Dawes, C.J. 1986. Botánica Marina; Editorial Limusa S.A., México D.F. 1ra Edición pág 394-448.
5. - Chapman, V.J. 1970. Seaweed and their uses; 2th. Methven, London.
EXTRACCION DE CARBOHIDRATOS (ácido algínico) DE LA ESPECIE GRATEOLUPIA DORYPHORA (ALGAS PARDAS- ANCON -PERU)
Otilia Acha de la Cruz
Facultad de Ciencias, Universidad Nacional de Ingeniería
RESUMEN
De las hojas y raices de la especie Grateoloupia Doryphora fueron extraidas separadamente el manitol cristalino y dos ácidos oliguronicos, ambas extracciones se hicieron en etanol. Los "fucans" estuvieron presentes en todas las extraciones secuenciales acuosas acídicos y básicas. Cada tipo de "fucan" contenía proporciones variantes de fucosa (mayor porcentaje),galactosa, manosa, xilosa,acido glucuronico, sulfatos y pequeñas proporciones de proteinas.
Los alginatos se extrajeron directamente en medio alcalino, la diferencia de las extracciones secuenciales en ambas partes de la planta fue la mayor cantidad de ácido gulurónico presente en el acido algínico extraido en las raices de la planta.
ABSTRACT
Stipes and frond were extracted separately. Cristalline manitol and two oliguronic acids were separated from the ethanolic extracts of both parts of the algae. Fucans were presents in all the sequential aqueous, acidic and alkaline extracts. Each of the fucans contained varyring proportions of fucose (major), galactose, mannose, and glucuronic acid, half ester sulfate and small proportions of protein. Alginates (alginic acid) were present in the secuential and direct alkaline extracts. The only significant differences were the higher proportión of glucuronic acid in the alginic acid from the stipes.
INTRODUCCIÓN
La mayoría de las investigaciones químicas en carbohidratos han sido llevadas a cabo en algas pardas.
El mar peruano cuenta con un potencial algológico elevado, de algas pardas, las cuales tienen mayor importancia económica, porque se destinan principalmente a la producción de ácido algínico.
El presente trabajo tuvo como finalidad realizar un estudio experimental sobre la extracción del ácido algínico y alginato de sodio en algas pardas (PHAEOPHYTA), orden LAMINARIALES, de la especie GRATEOLOPIA DORYPHORA de la zona de Ancón.
El estudio se hizo en la planta completa (raices, hojas y tallos).
Se ha demostrado que en los alginatos de ácidos "Grateolopia Doryphora", hay residuos de ácido gulurónico los cuales se incrementan desde la raiz a las hojas, también se ha encontrado laminarina y ácidos oligurónicos [1]
Algina es un término de referencia para el ácido algínico y sus derivados de sodio, amonio, potasio, propilenglicol, etc. Se presenta en casi todas las algas pardas como principal constituyente de su pared celular [2]
Las alginas se extraen por medio de un álcali, y luego de blanquearlas se precipitan, filtran, coagulan, neutralizan, deshidratan y muelen, sus propiedades varían según la materia prima y método del proceso de extracción.
En el mercado se conoce como grado refinado (para alimentos) y técnico (comercial), la algina refinada está libre de celulosa, los cuales se eliminan por filtración y el producto es blanqueado y purificado, en cambio, la algina comercial contiene celulosa y no se blanquea (es un proceso costoso y dificil [3]
Una de las cualidades más sobresalientes de la algina es su alta capacidad de absorción de agua, cualidad que la convierte en uno de los productos más utilizados por numerosas industrias que requieren de agentes espesantes, estabilizante, emulsificante de suspensión y que formen un gel o película coloidal [4]
El ácido algínico por otro lado tiene una alta capacidad de reacción. Puede ser mezclado con álcalis, amonio, aminas y bases orgánicas formando sales solubles en agua como alginatos de amonio, fierro, litio, magnesio, potasio, sodio o sales insolubles en agua como; alginatos de aluminio, cobre, níquel, plata, zinc [5]
Los más importantes son los alginatos de sodio, potasio, amonio y calcio, su empleo es alto y variado en diferentes Industrias; Industria alimentaria, Farmacológica y otros [6]
PARTE EXPERIMENTAL
Para tener una idea del porcentaje de carbohidratos y otros constituyentes en la planta, se realizaron varios análisis químicos previos, a fin de realizar un buen proceso de extracción de las alginas.
Los análisis químicos de; calcio, magnesio , sodio y potasio se realizaron por el método de absorción atómica, el nitrógeno, sulfato, carbohidratos, materia insoluble, y sílice se determinaron por métodos clásicos, los halógenos se determinaron con electrodos selectivos .
ANÁLISIS QUÍMICO DE LAS ALGAS
La muestra investigada fue recolectada en las costas de Ancón en los meses de junio - septiembre de 1995, después de una limpieza y secado correcto (se colocó sobre papeles, protegido directamente del sol con un techo de calamina y en forma natural después de 07 días se secó total-mente), fue finamente pulverizada (malla 75 um). Se tomó 150 mg y se hizo un análisis químico previo para determinar el contenido de carbohidratos y minerales en la planta completa cuyos resultados se muestran en la tabla 1.
Tabla 1. Análisis Químico en GRATEOLOUPIA DORYPHORA (polvo fino)
|
CONSTITUYENTE |
PORCENTAJE (%) |
|
Nitrógeno |
14.88 |
EXTRACCIÓN ACUOSA DE ALGAS CARBOHIDRATOS
Para la extracción de carbohidratos, se tomó 250 g de alga seca finamente pulverizada y se sometió a un proceso de extracción (raices y hojas en forma separada) en medio acuoso, en diferentes temperaturas frio y caliente.
También se hizo una tercera extracción (250g de alga) con 80 % de etanol, en donde se tomó la mitad del extracto etanólico para hacer los estudios del contenido de manitol, laminarina y acidos urónicos ( comunmente se encuentran con el ácido algínico) y en la otra mitad, se hizo un tratamiento con 100 ml de HCHO acuosa (30%), el material residual separado fué extraido secuencialmente con 2% de CaCl2 , acidificado con HCl 2N hasta pH =2 (llevado en un proceso frio y luego calentando hasta 70 oC), finalmente fué tratado con Na2CO3 aq.(50%). El acido algínico del extracto alcalino fue separado de acuerdo al siguiente método GLOAHEC-HERTER [7], el cual comprende las siguientes etapas:
Extracción; Se añadió a la muestra lixiviada una solución de Na2CO3 al 4% en relación 3 a 1 con respecto al peso de alga húmeda, se calentó durante 1h, 30 min. a temperatura de 60ºC, y se hizo la centrifugación.
Clarificación; La solución que contenía la algina impura (celulosa y otras impurezas) se diluyó con agua en proporción 3 a 7, agitando hasta formar una suspensión homogénea. Se procedió a cen-trifugar la celulosa del alga.
Blanqueado; A la solución en caliente se añadió 0.5g de carbón activado, calentado durante 10 min a una temperatura de 60ºC,luego se filtró.
También se hizo otro proceso de blanqueo en forma paralela con hipoclorito de sodio, pero los resultados fueron negativos porque el acido algínico se solubilizó.Precipitación. A la solución que contenía el alginato de sodio se añadió HCl al 10% hasta obtener un pH = 2, se precipitó el ácido algínico, posteriormente realizó una filtracion al vacío, un lavado con alcohol etílico, y finalmente un secado a 40ºC, y se determinó un rendimiento de ( % de rendimiento = (29.56/125)x100) 23.65%.
- Obtención del alginato de sodio. Al producto obtenido se agregó 50 ml de agua y luego 20 ml de Na2CO3 al 4% hasta tener un pH neutro y convertir el ácido algínico en alginato de sodio; el cual se secó en la estufa a una temperatura de 60ºC durante 5 horas.
INVESTIGACION EN LOS EXTRACTOS ACUOSOS
Cada uno de los extractos acuosos (raíces y tallos separados) fueron dializados y sometidos a un proceso de concentración, obteniéndose sustancias de aspecto jarabe, los cuales fueron hidrolizados en medio acido (pH = 3), luego se tomaron alicuotas (50 mg) y fueron estereficados con 50 ml de HCl-MeOH al 3%. Los derivados esterificados fueron reducidos con hidrogeno naciente, procedente de la reacción; HCl-Zn, secuencialmente se hizo la caracterización de los acidos urónicos con m - hidroxilbifenil ( en un tubo de ensayo se tomó 5 ml de la muestra y se agregó gotas del reactivo m- hidroxilbifenil al 2%, hasta observar coloración amarillenta). En los extractos acuosos en frio y en caliente se hicieron los análisis químicos; las proteinas se determinaron por método Kjeldahl,los sulfatos por método gravimétrico, los carbohidratos se determinaron por el método de oxidación directa con acido periódico, los ácidos urónicos se determinaron por el método espectrofotométrico. Cuyos resultados se encuentran en la tabla 2.
Tabla2. ANALISIS EN EL EXTRACTO
ACUOSO DE ALGAS
|
Ms |
Carb. a.urón. sulfato
prot. |
|
A |
46
18 09
6.8 |
|
|
|
raices extraidas en frio = A |
|
hojas extraidas en frio = B |
|
raices extraidas en calor = C |
|
hojas extraidas en calor = D |
ANALISIS FISICO-QUIMICO DEL ACIDO ALGINICO (obtenido de las hojas)
A continuación se indican los ensayos fisico-químicos que se hicieron en la muestra de acido algínico, extraidos de las hojas, respecto a la humedad se debe tener especial cuidado porque es muy higroscópico, en soluciones acuosas de 1 % muestra un pH neutro y es muy viscoso, el color ligeramente verduzco se debe a que no hubo decoloración total, respecto al tamaño de las partículas el tamaño mayoritario es 10 mesh.
Humedad = 10.21 %, en condiciones nor-males el ácido algínico es muy higroscópico
pH de la solución acuosa (1 %) = 9.0
Viscosidad de la solución acuosa al 1%en peso =23.4 cps
Color: Blanco verdusco.
Solubilidad = es insoluble en al-cohol, éter, glicerol y agua fría y poco soluble en agua hirviendo.
Actividad óptica = tiene un poder rotatorio de 132.6º
Equivalente de neutralización = 176.
- Tamaño mayoritario de las partículas = 10 mesh.
El ácido algínico obtenido de las raices, cumple con las características similares, excepto con la viscosidad (tiene un valor muy bajo, es de 5.37 cps).
PROPIEDADES FISICAS Y QUIMICAS DEL ACIDO ALGINICO Y ALGINATOS
Se observaron varias propiedades físicas y químicas del acido algínico y de sus sales (alginatos), las cuales son muy usadas en la industria alimenticia, entre las propiedades mas importantes son:
El ácido algínico; cuando está húmedo absorbe varias veces su peso en agua, si se seca, se endurece mucho, se vuelve córneo y resistente a los disolventes, no reduce la solución de Fehling, pero forma rápidamente sustancias reductoras cuando se seca a 100?C o se hierve con ácido diluído ( HCl 2 N).
El ácido algínico es un ácido débil, pero su constante de disociación es suficiente para desprender dióxido de carbono de las soluciones de carbonatos, el ácido algínico puede ser titulado con álcali (NaOH 2N) usando como indicador fenolftaleína.
Las sales de ácido algínico con metales alcalinos, amonio, magnesio y aminas inferiores son hidrosolubles. Otros alginatos son insolubles en agua. Los alginatos solubles son coloides muy hidrófilos que forman soluciones sumamente viscosas a baja concentración. Por ejemplo la solución 1% de alginato sódico, puede tener la viscosidad aproximada de 1000 centipoises a 17ºC. La viscosidad de las soluciones de algina varía mucho según el método de preparación.
El pH del alginato de sodio dió una medida aproximada de 7.8; en la industria conviene emplear algina con intervalo de pH de 4 a 10. Cuando el pH es menor de 4, el ácido algínico tiende a precipitarse, y si pasa de 10 pierde rápidamente su viscosidad y tiende a volverse inestable. El aumento de la temperatura reduce la viscosidad de las soluciones de algina.
Efecto de la temperatura en el ren-dimiento; el efecto de la temperatura en el proceso de extracción del acido algínico afecta sobre el rendimiento, en la tabla 3, se muestran los re-sultados a diferentes variaciones de temperatura, siendo aparentemente el mas óptimo la extracción a 70 oC, en donde se obtuvo un rendimiento de 15.5 %, pero hay algunas observaciones.
|
Tabla 3. |
Rendimiento en ácido algínico con |
|
alga |
temp. |
% ácido |
|
R |
70.0 |
15.5 |
OBSERVACIONES
De la tabla anterior se estableció que la tem- peratura óptima de extracción es 60ºC, por las siguientes razones:
La temperatura tiene influencia sobre la viscosidad de los alginatos, porque a una temperatura 70ºC se observó disminución de la viscosidad, considerando que por cada grado de aumento de la temperatura, disminuyó en 2.5% la viscosidad del producto (siendo la viscosidad irreversible).En cuanto a las características del producto final se puede apreciar que a 60ºC el color de la solución de extracción y del producto es pardo bajo mientras que a mayor temperatura presenta un color pardo oscuro (el ácido algínico tiende a hidrolizarse).
El hipoclorito de sodio como blanqueador tiene una influencia negativa en el rendimiento del producto, puesto que el ácido algínico se solubiliza. Se asume ésta afirmación por los resultados obtenidos en los experimentos al blanquear con hipoclorito de sodio.
RESULTADOS Y DISCUSION
Analizando los resultados de la tabla 1, se observa que los constituyentes mayoritarios son los carbohidratos, por lo que se recomienda hacer una extracción industrial del ácido algínico a partir de esta especie, respecto a los otros constituyentes (materia residual), por el contenido de nitrógeno ( 14.88%), sulfatos (13.52%) y minerales puede servir para la elaboración de fertilizantes mezclado con otras sustancias específicas revitalizadoras (fósforo, calcio, sodio y potasio).
El manitol recuperado del extracto etanólico y recristalizado (de 50g de raices y hojas se obtuvo 53 y 68 mg respectivamente), los cuales fueron caracterizados por el punto de fusión, teniendo un patrón de referencia auténtico de manitol con un punto de fusión de 165o C.
Respecto a la laminarina la variación de porcentajes es muy fluctuante ( 5 al 12 %), esto depende de la estación de recolección de las algas (lo cual merece un estudio con mayor detenimiento).
Del extracto etanólico madre (concentrado hasta obtenerse una especie de jarabe), se observó por cromatografía de papel la presencia de dos ácidos oligurónicos, los cuales fueron hidrolizados en medio ácido (25 ml de HCl 2N), los compuestos hidrolizados de ambos materiales contenían fucosa (mayor cantidad), xilosa, manosa, galactosa y ácido glucorónico, los cuales fueron caracterizados mediante patrones de referencia en cromatografia de papel.
De los resultados de análisis en los diferentes concentrados acuosos (tabla 2), se observa que el mayor porcentaje de carbohidratos (59%), se obtiene en las hojas durante la extracción en caliente, por lo tanto en este medio se extrae en mayor cantidad el ácido algínico.
La viscosidad relativa del ácido algínico, sol. al 1 % (extraido de las hojas) es bastante alta (23.4 cps) con relación al ácido algínico extraido de las raices (5.36 cps), lo que indica que las propiedades físicas de las alginas extraidas de las algas marinas, son fuertemente influenciadas por la presencia de los ácidos manuronicos y residuos de ácidos gulurónicos. Por ejemplo, cuando se extrae en frio el ácido urónico de las raices, se observa la obtención de mayor porcentaje (18%) con referencia a las hojas(5%) .
Respecto al contenido de sulfatos, este se encuentra en porcentaje mayoritario en las hojas (12%) , cuando se realiza la extracción en caliente. Lo mismo sucede con las proteinas, donde se obtiene hasta un 11.3%.
CONCLUSIONES
Esta especie de alga marina peruana, merece ser industrializada como fuente de acido algínico y por la composición de sus minerales residuales se puede utilizar en la Industria de fertilizantes. En el Japón esta especie, es utilizada como fuente de ácido algínico y adicionalmen te en la Industria de fertilizantes.
SIMBOLOGIA
| Ms | = | muestra |
| carb. | = | carbohidrato |
| a.urón. | = | ácido urónico |
| prot. | = | proteina |
AGRADECIMIENTOS
Agradezco infinitamente a la Dra Olga Lock de Ugaz, por su extenso apoyo en el desarrollo de mi trabajo de investigación asi como su asesoría en todo momento.
Agradezco a todo el personal del IGI de la F.Ciencias, especialmente al Dr. Manfred. Horn. Por alentarme a publicar mis trabajos de Investigación.
Agradezco al CONCYTEC por el apoyo económico.
REFERENCIAS
ESPINOZA, Atencia. "Implementación de una planta piloto para la extracción del ácido algínico". Tesis de Ingeniero Pesquero, Universidad Nacional Agraria, 1977 pp. 90-91
ACLETO, César. "Algas Marinas del Perú de Importancia económica". U.N.M.S.M. Museo de Historia Natural, Departamento de Botánica, 1986 pp. 88-107
STOCKTON, B, EVANS "Alginate industries " (1980) Bot. Mar.XXIII pp 563 -569.
Jabbar Mian,A. and Percival,E.(1973) Carbo hydrat. Res.26,133.
Sociedad Nacional de Pesquería. Empresa Pública de servicios Pesqueros, EPSEP. Gerencia de Producción y Proyectos. "Estudio de Pre-factibilidad de Industrialización de un Planta Piloto de alginatos"
VARGAS Rodrigo. "Determinación de Acidos Urónicos en el Acido Algínico obtenido a partir de las Algas Lessonia Nigrescens Bory, Vol. LX, 1974 pp. 55-64
COPYRIGHT © 2000 - 2010 ALNICOLSA del Perú S.A.C.
Prohibida
su reproducción total o parcial, así como su traducción a
cualquier idioma sin autorización escrita de su titular
Reproduction in whole or in part, or translation without written
permission is prohibited. All rights reserved